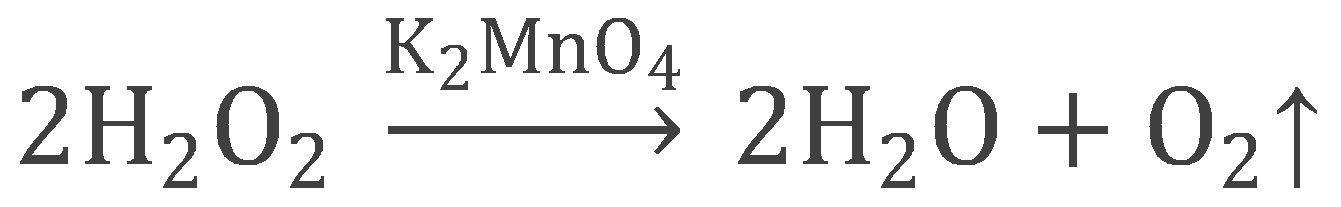Описание: При нормальных условиях кислород О2 – это газ без цвета, вкуса и запаха. Немного тяжелее воздуха.
В больших количествах кислород можно получить из перекиси (пероксида) водорода H2O2. В аптеке H2O2 продается в виде 3% раствора – как дезинфицирующее средство или препарат для обработки ран. Пероксид водорода мало устойчив. Уже при пребывании на воздухе он разлагается на кислород и воду:
2H2O2 = 2H2O + O2
Разложение можно существенно ускорить, если добавить к пероксиду немного перманганата калия, активированного угля, металлического порошка, крови (свернувшейся или свежей), слюны, эти вещества действуют как катализаторы.
В нашем опыте мы использовали реакцию каталитического разложения пероксида водорода Н2О2 в присутствии перманганата калия KMnO4 (если простыми словами, то добавить марганцовку в перекись водорода):
Мы в этом убедились, поместив в стакан с перекисью водорода немного кристаллов марганцовки (калия перманганат), а наличие выделяющегося кислорода установили с помощью пробы тлеющей лучиной.
Дело в том, что кислород является хорошим окислителем. А горение – это процесс быстрого окисления с выделением тепла и света. Поэтому, при внесении тлеющей лучинки в кислород, реакция горения резко ускоряется и появляется пламя.
Вы можете самостоятельно испытать каталитическое действие на перекись водорода органических веществ (молока, сахара, размельченных листьев зеленых растений и т. д.). Вы на опыте убедитесь, что различные вещества каталитически ускоряют разложение пероксида водорода.
Катализаторы повышают скорость реакции химического процесса и при этом сами не расходуются. | |
| Просмотров: 10708 | | |